Perkembangan Sistem Periodik Unsur
A. Pengelompokan Unsur Cara Lovoisier
Perkembangan Sistem Periodik ini di temukan oleh Antonio Lovoisier, pada tahun 1869 yang mendefenisikan unsur sebagai zat yang tidak dapat di uraikan lagi menjadi zat yang lebih sederhana. Berikut ini tabel unsur periodik Lovoisier.
 |
| http://3.bp.blogspot.com/-GhOzkFiLvf8/VFD9k6bAFlI/AAAAAAAAAjA/77fiB4UcqVU/s1600/kimia1.JPG |
B. Pengelompokan Unsur Cara Dobereiner
Pada tahun 1817, ilmuan asal jerman,Johan Wolfgang Dobereiner, membuat pengelompokan unsur-unsur kimia. Dobereiner mengelompokkan unsur-unsur berbeda dengan cara Lovoisier. Dobereiner mengelompokkan setiap 3 unsur kimia yang sifatnya mirip menjadi satu kelompok (triad) berdasarkan kenaikan berat atomnya. Pengelompokan Unsur jenis ini dikenal dengan nama HukumTriad Doboreiner.
 |
| https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEhYRR3mQhyphenhyphenAMmLqbQYcWkJy4kNk8TYFaFlJJ5zM1cK39hQJCiiZGWufpIlKZBxvlAaEz_CzBT1XfpDfWsB0phjd7xpAlj4E3P9SLkU7Yc_iAG7sqGpAje5tfKKE7VuIFKHkwNFVoO7zhuM/s1600/Sistem+Periodik+2.jpg |
C. Pengelompokan Unsur Cara Chancourtois(Telluric Spiral de Chancoutois)
Pada tahun 1862, ahli geologi Prancis , Alexander Beguyar de Chancoutois, mengelompokkan unsur-unsur kimia berdasrkan kenaikan atom. Unsur-unsur kimia disusun membentuk suatu spiral.
 |
berikut.https://vitajoo.files.wordpress.com/2013/05/4.png
Unsur-unsur yang sifatnya mirip terletak pada kolom yang sama . Perbedaan berat atom unsur-unsur yang mirip adalh 16. Misalnya , litium dan antrium (7 dan 23). Secara matematis , penyusunan ketiga unsur kimia tersebut dapat di rumuskan dengan persamaan sebagai berikut.
|
Berat atom =7+16n
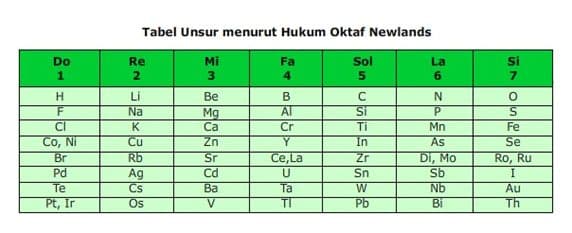
D. Pengelompokan Unsur Cara Newlend (Hukum Oktaf)
John Alexaner Reina Newlends seorang ahli kimia inggris . Newlends karena idenya tentang pengelompkan unsur-unsur kimia yang dikenal dengan Hukum Oktaf.Newlend mengelompokkan unsur-unsur kimia berdasarkan kenaikan berat atom, dia menemukan hubungan antara sifat unsur dan kenaikan berat atom. Sifat-sifat unsur akan berulang pada unsur ke delapan (oktaf) sehingga unsur kedelapan akan mempunyai sifat yang sama dengan unsur pertama.
Sebagai contoh Li(litium) unsur kedua akan memiliki kemiripan sifat dengan NA(natrium) unsur ke Sembilan.Unsur-unsur yang sifatnya mirip[ terulang setiap kelipantan delapan.
Tidak semua unsur disusun berdasarkan kenaikan berat atom.Newlend menukar posisi Zn dan Y karena lebih mirip dengan BE.Dmikian juga denagn Ce/La,dan Zr, U dan Sn, Tedan I serta TI, Pb, Th, Hg, Bi, dan Os.
 |
| https://www.gurupendidikan.co.id/wp-content/uploads/2018/09/Tabel-Periodik-Unsur-Hukum-Oktaf-Newlands.jpg |
Kelemahan hukum oktaf ini adlah berlaku untuk 17 unsur pertama, yaitu dari hidrogen hingga kalsium. Selain itu, hokum oktaf juga tidak menyedikan tempat unsur-unsur yang baru ditemukan. Meskipun demikian, upaya Newlends patut dihargai karena ia yang pertama kali menunjukkan bahwa unsur-unsur kimia bersifat periodic.
E.Tabel Periodik Mendelev dan Meyer
Pada tahun 1869, Dmitri Mendelev dari Rusia dan Julius Lhotar Meyer dari Jerman menem,ukan cara baru untuk menyusun unsur-unsur kimia .
- .Tabel Periodik Mendelev
 |
| https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgnIDDxJUzYt2ef8RQynSFhVz4kEiDwjzlbPRSfszRTgdMGMUzI6dH2xfcK52M4AgQusisdzhcU0B857q_peQUo6PYLLFwXHo6SVvgQoIfLINUhd9B8EB7qA-CFUk8WDGmX0A_87uLtj_s/s870/tabel-periodik-yang-diputar-90-derajat-oleh-mendeleev.png |
Mendelev menemukan bahwa jika unsur disusun menurut atom yang mengikat, amkunsur dengan sifat-sifat yang sama akn tersusun secara periodic, ia mereaksikan beberapa unsur dengan gas klor .Hasilnya adalah senyawa yang larut dalam air rumus umum MCL. Fakta yang sama ditunjukkan oleh unsur Be, Mg ,Ca, dan Sr yang membentuk senyawa BeCl2, MgCl2, CaCl2, dan SrCl.
Mendelev juga menyusun unsur-unsur menggunakan kartu yang jumlahnya sama dengan jumlah unsur yang saat itu diketahui. Ia menemukan pengulangan sifat unsur dalam daftar unsurnya
2. Tabel Periodik Meyer
Lhotar Meyer menyusun table Periodik yang hampir sama dengan Mendelev. Akantetapi, ia tidak dikenal sebagai bapak Tabel seperti Mendelev. Pada tahun 1864(5 tahun sebelum Mendelev mengemukakan table peridiknya), Meyer menyusun 28 unsur berdasarkan valensi dalam bentuk table.
 |
| https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjJFtd8JXP2vHwAP9FinK0ZaC90jcnJb0J6-JegM4tWoRGy85c9YA7MwIZ0PGFA-duApBx-NftuEtI5XFY0_GOj7Ahz_kX2D04p0nIiBAwvtdE4lOdV-Eejzc7VJMtzNxsDTurTY9XZIT9m/s1600/Tabel-Periodik-Meyer-yang-Berdasarkan-pada-Grafik-antara-Volume-dan-Massa-Atom.jpg |
Meyer menempatkan unsur-unsur dengan Valensi yang sama dalam satu kolom.Gagasan Meyer lebih sederehana dibandingkan table periodic Mendelev . Sayangnya, Meyer baru Mempublikasikannya pada tahun 11870.
Sumber:
Sumber:
https://www.google.com/search?q=tabel+unsur+meyer&sxsrf=ACYBGNRef2EBojzfoANtsqX3Q3yUsbYtZA:1573654543862&source=lnms&tbm=isch&sa=X&ved=0ahUKEwj75NeAsOflAhVLuY8KHbyOA5UQ_AUIEigB&biw=1366&bih=657#imgrc=dJnPtll2AGDjOM:
Justiana, Sandri dan Muchtaridi.2009. kimia 1. Jakarta:Yhudistira
Justiana, Sandri dan Muchtaridi.2009. kimia 1. Jakarta:Yhudistira



